Hémochromatose
Définition • D’où vient cette surcharge en fer ? • Symptômes • Diagnostics • Traitement efficace • Et lorsque les saignées sont contre indiquées ? • Dépistage de la maladie
L’HH est la maladie Héréditaire la plus fréquente, il s’agit de la première maladie génétique en France. L’Hémochromatose évolue insidieusement, elle est bien souvent asymptomatique jusqu’à 50-70 ans, âge à partir duquel de nombreuses complications cliniques se manifestent, reflétant une altération irréversible des organes. Le principal traitement de l’hémochromatose est la saignée.
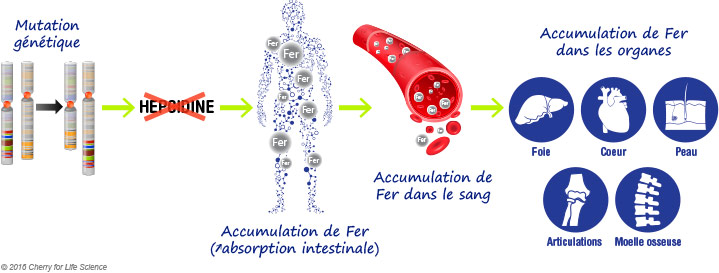
Cependant, la découverte d’un lien entre l’Hepcidine (protéine limitant l’absorption du fer) et le fer par une équipe de l’Unité de recherche INSERM de Rennes (U522) montre une avancée majeure de la recherche dans la découverte de nouvelles thérapeutiques.

Définition : un excès de fer dans l’organisme
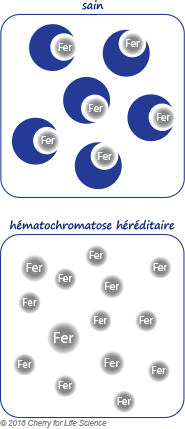
L’hémochromatose est une maladie héréditaire (HH : Hémochromatose Héréditaire) causée par une absorption excessive du fer apporté par l’alimentation au niveau du tube digestif (duodénum) aboutissant à une accumulation progressive en fer dans différents tissus, principalement le foie, le pancréas, les os et le cœur. Cette surcharge ferrique, conséquence d’une hyperabsorption intestinale du fer alimentaire, est due à une mutation génétique résultant de la diminution de l’expression hépatique de l’hepcidine contrôlant l’absorption du fer au niveau du système digestif.
La mutation du gène HFE, situé sur le chromosome 6, est la principale mutation responsable de l’hémochromatose (hémochromatose génétique HFE de type 1). Les symptômes de la maladie se manifestent exclusivement chez les personnes homozygotes (dont le gène est muté sur les 2 chromosomes 6).
L’hémochromatose est la maladie héréditaire la plus fréquente, elle est la première maladie génétique en France : elle touche en moyenne 1 Français sur 300 soit 200 000 patients en France. 2 200 000 personnes sont concernées en Europe et 2 000 000 aux USA. La prévalence des hétérozygotes (personne présentant la mutation de l’hémochromatose sur un seul des deux chromosomes 6) est de 10%. Les hétérozygotes ne présentent aucun risque de présenter la maladie mais la transmettent, ils sont dits « porteurs sains».
L’hémochromatose évolue insidieusement sans présenter au début de symptômes particuliers. Les risques majeurs d’une hémochromatose non traitée sont les atteintes sévères telles que la cirrhose hépatique conduisant au cancer du foie ou l’insuffisance cardiaque, susceptible d’entraîner une mort prématurée.
D’où vient cette surcharge en fer ?
- dans les globules rouges, associé à l’hémoglobine dans la myoglobine des muscles
- sous forme de ferritine et d’hémosidérine contenue dans le foie dans la moelle osseuse
L’apport journalier en fer est en moyenne de 20 mg via l’alimentation. Seulement 1 à 2 mg sont absorbés grâce à l’hepcidine, le reste est rejeté dans le tube digestif (selles), la sueur ou l’urine.
Une fois absorbé, le fer sanguin est transporté par la transferrine (protéine, chargée à 30% de sa capacité) jusqu’à la moelle osseuse où il entre dans la composition de l’hémoglobine. Le fer associé à l’hémoglobine est essentiel à la fixation de l’oxygène au niveau des poumons.
Dans le cas d’hémochromatose héréditaire, en l’absence d’hepcidine, 5 à 8 mg de fer sont absorbés quotidiennement. La transferrine charge le fer au maximum de sa capacité (80 à 100%), elle est dite saturée à 80-100%. Au fur et à mesure, cette hyperabsorption conduit à un excès de fer qui s’accumule un peu plus chaque jour dans les organes (foie, cœur, reins, pancréas, articulations, la peau…) les endommageant petit à petit, ce qui explique une pigmentation cutanée excessive, le diabète, l’arthrite, et certains troubles cardiaques. Ainsi, le taux de ferritine (stock de fer) augmente au fur et à mesure, passant de 300 ng/ml à 1 000 ng/ml, puis à 3 000, à 5 000… Avec les années (30 à 40 ans), cette accumulation atteint une surcharge en fer comprise entre 10 et 40 g qui doit être éliminée par le seul biais des saignées.
Contrairement aux autres métalloïdes tels que le sillicium, l’arsenic et d’autres, il n’y a pas de régulation de l’excrétion du fer par l’organisme d’où son accumulation néfaste pour le corps.
Symptômes
Cette maladie génétique ne présente de symptôme que tardivement, une fois que les organes sujets à l’accumulation de fer sont endommagés. De ce fait, l’hémochromatose est bien souvent asymptomatique jusqu’à l’âge adulte (30-40 ans) où des symptômes très variés peuvent se manifester :
- un pancréas endommagé peut engendrer un diabète
- des articulations endommagées se manifestent par des douleurs articulaires (surtout des 2e et 3e doigts : poignée de main douloureuse)
- une atteinte de la peau entraine une mélanodermie (peau grisâtre ou anormalement bronzée)
- des dysfonctionnements cardiaques peuvent être observés (troubles du rythme ou insuffisance cardiaque)
- une atteinte du foie se traduit par : des anomalies des tests sanguins hépatiques, une augmentation du volume hépatique qui peut évoluer vers une cirrhose avec un risque élevé de cancer du foie.
- une fatigue chronique inexpliquée
- des troubles sexuels : une impuissance chez l’homme, une diminution de la libido, une aménorrhée précoce.
Diagnostic
Un diagnostic précoce, à l’âge de 20-35 ans et non à 60-70 ans, est indispensable pour limiter l’atteinte délétère des organes cibles du stockage de fer. Le fer s’accumulant jour après jour dans ces organes, la gravité des signes cliniques sera corrélée à l’âge du patient.
Trois tests biologiques permettent le diagnostic de l’hémochromatose héréditaire :
- La saturation de la transferrine(à jeun) : quantité de fer lié à la transferrine (protéine de transport du fer).
- La ferritinémie(mesure du stock de fer) qui est très élevée en fonction de la surcharge en fer (excepté chez la jeune femme réglée ou chez les personnes faisant des dons de sang réguliers).
- Dépistage génétique: la détection de mutation du gène HFE, si les deux premiers tests apparaissent anormaux, permet avec certitude de poser le diagnostic.
Une fois le diagnostic établi, il est préférable de poursuivre avec un bilan général comprenant :
- IRM : permet d’évaluer la surcharge en fer dans le foie.
- Recherche de la possibilité d’un diabète sucré.
- Recherche de lésions osseuses.
- Recherche de lésions cardiaques.
Si le diagnostic est réalisé tardivement
Malheureusement l’hémochromatose est bien souvent découverte tardivement, entre 50 et 70 ans, au moment où les organes présentent déjà de nombreuses altérations irréversibles. On observe notamment :
- une fatigue permanente pouvant conduire à une invalidité et à l’arrêt de l’activité professionnelle associée à un état dépressif.
- des lésions ostéo-articulaires (graves chez 60% des patients) très douloureuses mimant une polyarthrite rhumatoïde avec des accès de synovite ou la goutte. De plus, la ménopause précoce induite par un déficit hormonal lié à la surcharge en fer conduit à une ostéoporose accentuée.
- une atteinte hépatique touchant 95% des patients. En effet, lorsque la ferritine est supérieure à 1000 ng/ml et que les aspartate amino-transférases (ASAT : enzyme du foie) sont supérieures à 50 UI/l, le diagnostic d’une cirrhose hépatique est à envisager. De plus, une consommation excessive d’alcool associée à l’hémochromatose héréditaire augmente d’un facteur 9 le risque de cirrhose.
- un diabète sucré bien souvent insulino-résistant apparaît dans 40 à 60% des cas du fait de la destruction, par l’accumulation de fer, des cellules β du pancréas (responsable de la sécrétion de l’insuline).
- des atteintes cardiaques liées à l’accumulation de fer dans le myocarde telles que des troubles du rythme (fibrillation) ou une cardiomyopathie dilatée avec insuffisances cardiaques, voire une cardiomyopathie constrictive, sont observées chez 15% des patients.
- une hyperpigmentation de la peau appelée mélanodermie (teinte gris verdâtre) due à une stimulation de la synthèse de mélanine (protéine contenue dans les cellules de la peau : mélanocytes) s’observe dans 90% des cas. A ceci est associée une déformation des ongles, une pilosité diminuée et une peau plus fine.
La variation selon les patients de la gravité des complications faisant suite à l’hémochromatose héréditaire est liée aux facteurs environnementaux régulant l’absorption du fer (la vitamine C par exemple), aux facteurs aggravants (alcool, hépatites virales) ainsi qu’au patrimoine génétique. Ce qui explique que certains malades peuvent présenter une simple fatigue ou des douleurs articulaires, tandis que d’autres montrent de multiples complications graves comme celles décrites ci-dessus.
Le savez-vous ?
Il faut distinguer l’HH des autres surcharges en fer héréditaires et des surcharges en fer acquises.
On connaît de plus en plus de surcharges en fer héréditaires qui restent cependant des formes très rares (2 à 3 %). Les surcharges en fer acquises, quant à elles, sont observées dans le cas de :
- maladies alcooliques du foie et d’hépatite chronique C.
- syndrome métabolique lié à une obésité, une hypertension artérielle ou un diabète avec un gros foie stéatosique ou cirrhosé. Les saignées normalisent cette surcharge en fer ; la perte de poids et une alimentation équilibrée sont obligatoires.
- maladies du sang telles que des anémies hémolytiques (libérant le fer par éclatement des globules rouges). L’exjade ® est un médicament très efficace dans ce cas de figure.
Un traitement efficace
Le traitement de l’hémochromatose Héréditaire est basé sur les saignées. Il s’agit d’un traitement simple, indolore et peu coûteux, initialisé lorsque la ferritinémie est supérieure à 300 µg/l pour un homme, ou supérieur à 200 µg/l pour une femme. Il s’établi en deux temps :
- Le traitement d’induction pour éliminer la surcharge en fer : le rythme des saignées est hebdomadaire, il consiste en général à prélever un volume de sang de 7ml/kg sans jamais dépasser 550ml par saignée pendant 1 à 2 ans en fonction de la surcharge en fer pour atteindre une ferritinémie de 50ng/ml. Le volume de sang prélevé est adapté au cas par cas selon la tolérance du patient, de son âge et de son état de santé. La ferritinémie est évaluée toutes les 2 saignées et le taux d’hémoglobine, qui doit rester supérieur à 11 g/dl, est contrôlé 8 jours avant chaque saignée.
- Le traitement d’entretien pour maintenir une charge en fer ≤ à 50ng/ml : Il est poursuivi à vie. Certaines complications comme la mélanodermie et les troubles cardiaques peuvent s’atténuer voire disparaître. Cependant, les douleurs articulaires et le diabète une fois installé sont des complications qui ne disparaissent jamais complètement.
Et lorsque les saignées sont contre indiquées ?
- Les chélateurs du fer : prescrit dans le cas d’anémie, traitements lourds, contraignants et coûteux, avec des effets secondaires non négligeables.
- L’érythro-aphérèse: prélève uniquement les globules rouges afin d’éliminer le fer qu’ils contiennent. Le bémol de ce traitement, non remboursé par la sécurité sociale, est qu’il nécessite un appareillage complexe (séparateur de cellules) ce qui en restreint l’accès.
- L’hepcidine : la découverte de ce peptide impliqué dans la régulation de l’absorption du fer apporté par l’alimentation, apporte un nouvel espoir thérapeutique.
- La greffe du foie, dans le cas d’une cirrhose décompensée évoluant ou non vers un hépatocarcinome, est le seul traitement effectif de l’hémochromatose héréditaire.
Le savez-vous ?L’élimination des globules rouges, riches en fer, oblige l’organisme à puiser dans les stocks de fer pour en former de nouveaux, réduisant ainsi la concentration en fer dans le corps.
Dépistage de la maladie
Dans le cas où un membre de la famille est découvert homozygote pour la mutation C282Y et présente donc la maladie, un dépistage familial est recommandé. L’enjeu est important car ce sont souvent des sujets jeunes qui ne manifestent aucune complication clinique. De plus, le diagnostic précoce et le traitement (si nécessaire) leur offre une espérance de vie normale.
Qui doit faire le dépistage dans la famille du patient ?
- les frères et sœurs
- ses enfants majeurs,
- ses parents, à condition que ce dépistage leur apporte un intérêt en termes de prévention et de prise en charge. Il n’y a pas de limite d’âge exacte «l’âge physiologique compte plus que l’âge d’état civil ».
En quoi consiste ce dépistage ?A partir d’un échantillon de sang, un dépistage génétique est effectué afin de détecter la mutation C282Y. Dans le cas où le sujet est porteur de la mutation sur les 2 copies du gène (homozygote pour la mutation), une évaluation de l’augmentation des paramètres du fer sera effectuée (dosage du fer sérique, mesure du coefficient de saturation de la transferrine et mesure du taux de ferritine).
Un dosage des paramètres du fer seul ne peut servir de diagnostic, car la normalité de ces paramètres peut rassurer à tort et passer à côté du diagnostic d’hémochromatose. Seul le dépistage génétique peut confirmer le diagnostic.
Quelle démarche suivre ?
- c’est au malade lui-même de sensibiliser sa famille au dépistage de l’hémochromatose. Le médecin n’intervient pas lui-même pour tenir informés les membres de la famille du patient.
- La qualité de l’information apportée par le médecin à son patient est déterminante pour que ce dernier puisse trouver les arguments justes et nécessaires afin de convaincre sa famille de l’intérêt du dépistage.
- Pour améliorer l’efficacité du dépistage, le médecin peut :
- rédiger une lettre pour les membres de la famille du patient en question qui remettra ensuite la lettre aux membres de sa famille concernés par le dépistage,
- rédiger un courrier pour le(s) médecin(s) traitant(s) des membres de la famille à dépister.
- transmettre les dispositions réglementaires du dépistage génétique.
- Il est nécessaire que la consultation médicale soit faite par un médecin ayant les compétences cliniques et génétiques adéquates.
- Nécessité d’un consentement éclairé, signé par le patient pour qu’il accepte une étude génétique fait en 3 exemplaires (u pour le patient lui-même, un pour le laboratoire qui ne remet pas les résultats directement au patient et un pour le dossier du malade).
- au cours de la consultation, le médecin doit informer le malade des modalités de prise en charge thérapeutique.
La Haute Autorité de Santé (HAS) conseille vivement le dépistage familial (remboursé dans certaines conditions par la Sécurité Sociale).
Nathalie M. PhD
Cet article vous a-t-il été utile ?